materi asam basa
Teori asam basa
1. Menurut Arrhenius, asam adalah zat yang jika di dalam air melepaskan ion hidrogen (H+). dan basa adalah senyawa yang dalam air dapat menghasilkan ion hidroksida (OH-).contoh:
kelemahan teori Arrhenius :
- hanya bisa menentukan zat tsb asam/ basa jika sudah di larutkan
- pelarutnya hanya air, padahal pelarut bisa alkohol, amoniak dan lain-lain
- tidak semua senyawa bersifat asam/basa dapat menghasilkan ion H+/OH- jika dilarutkan dalam air
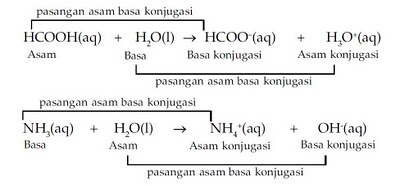
contoh :

HCl + NH3 à
NH4+ + Cl-
CH3COOH + NH3 à
NH4+ + CH3COO-
kelemahan teori Bronsted-Lowry:
- belum bisa menentukan asam/basa jika belum bereaksi
- belum bisa menentukan asam kuat/asam lemah dan sebaliknya.
3. Menurut Lewis, asam adalah zat yang dapat menerima elektron. Basa adalah zat yang dapat mendonorkan pasangan elektron.
contoh:

kelemahan teori lewis:
- hanya mampu menjelaskan asam-basa yang memiliki 8 ion atau oktet.
Mengukur ke-asaman/basaan suatu zat
Ada 2 cara untuk mengukur ke-asaman/basaan suatu zat, yakni dengan kualitatif dan kuantitatif.contoh dari kulalitatif adalah dengan membaca teori-teori asam basa sedangan kuantitatif dengan melihat Ka dan pH.
Memperkirakan Ke-asaman
1. Bagaimana cara anda untuk memperkirakan Keasaman suatu senyawa tanpa menghitung ka (catatan dengan konsentrasi yang sama)?- HF
- HCl
- HBr
- HI
Keasaman suatu larutan bisa dilihat dari seberapa mudah larutan tersebut dapat melepasakan ion H+/proton. faktor faktor yang mempengaruhi keasaman suatu larutan:
- keelektonegatifan, semakin lemah keelektronegatifan semakin kuat ion tersebut mengikat H+ sehingga semakin lemah ke-asaman larutan tsb (ph). Keelektronegatifan halogen sangat tinggi dan berada pada unsur Fluor (F), menurun hingga iodin (I).
- ukuran atom, jari-jari atom bertambah nilainya dalam satu golongan ke bawah sehingga mempengaruhi daya ikat elektron. misal F dan Cl tentu mempunyai jari jari atom yang berbeda. jari-jari atom Cl>F yang mengakibatkan daya ikat H+ Cl lemah karena lintasan orbit yang jauh. sehingga mudah lepas.
jadi anda sudah bisa memperkirakan mana larutan mana yang lebih kuat.... (HF)
2. Bagaimana dengan asam oksida?
thank you sudah membaca sampai akhir.
jika ada saran dan kritik komen saja, tetapi memakai kata yang sopan ya...
XD see you
sumber:
http://materiku86.blogspot.co.id/2016/05/teori-asam-basa-menurut-para-ahli-beserta-contohnya.html
https://brainly.co.id/tugas/2359791
https://amaldoft.wordpress.com/2015/10/12/golongan-viia-halogen-kimia-unsur/
- HClO4
- HClO3
- HClO2
- HClO
pada kasus ini lihatlah atom pusat Cl. di HClO4 atom pusat 'Cl' lebih banyak menarik atom O sebanyak 4 buah sehingga ikatan antara O dan H melemah mengakibatkankan H+ lebih mudah terlepas dibandingkan ketiga larutan yang lain.
3. bagaimana dengan atom pusat yang berbeda contoh HClO4 dan H2SO4 ?
lihatlah keelekronegatifan pada atom pusat. keelektronegatifan Cl lebih kuat dibandingkan S yang mengakibatkan tarikan O dan H lebih lemah pada HClO4 yang mengakibatkan asam HClO4 Lebih asam dibandingkan H2SO4.
ada pertanyaan unik nih kenapa H+ disebut sebagai proton?
thank you sudah membaca sampai akhir.
jika ada saran dan kritik komen saja, tetapi memakai kata yang sopan ya...
XD see you
sumber:
http://materiku86.blogspot.co.id/2016/05/teori-asam-basa-menurut-para-ahli-beserta-contohnya.html
https://brainly.co.id/tugas/2359791
https://amaldoft.wordpress.com/2015/10/12/golongan-viia-halogen-kimia-unsur/


Terima kasiih
BalasHapus